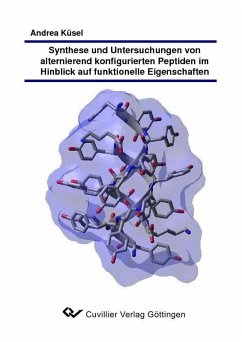
Die vorliegende Dissertation behandelt die Abhängigkeit zwischen der Sekundärstruktur D,L alternierend konfigurierter Peptide und ihrer funktionellen Eigenschaften.
Die strukturelle Vielfalt alternierend konfigurierter Peptide wurde in zwei Richtungen untersucht. Einerseits wurde, basierend auf der Kristallstruktur eines aromatischen alternierend konfigurierten Nonamers, ein Gramicidin A Analogon entwickelt und dessen strukturelles Verhalten und Interaktion mit zahlreichen Modellmembranen mittels Röntgenreflektivität und CD-Spektroskopie untersucht.
Die Ausbildung einer transmembranen -Helix in Abhähngigkeit von der Lipiddoppelschicht konnte über Differenzmessungen der Elektronendichteprofile der entsprechenden iodmarkierten Peptide belegt werden.
Dem zweiten Teil der Dissertation liegen die linearen Doppelstränge der Alanyl-Peptid-Nukleinsäuren (Alanyl-PNAs) und zyklische alternierend konfigurierte Peptide zugrunde. Diese beiden Strukturmotive wurden ausgenutzt, um Metallionen gezielt in einer hydrophoben Tasche zu koordinieren und eine mögliche resultierende katalytische Aktivität zu untersuchen. Untersuchungen über temperaturabhängige UV-Spektroskopie, EXAFS und ESR Experimente zeigten eine entsprechende Koordination der jeweiligen Metalle. Eine viel versprechende Phosphatase Aktivität konnte für die Zyklopeptide nachgewiesen werden.
Dieser Download kann aus rechtlichen Gründen nur mit Rechnungsadresse in A, B, BG, CY, CZ, D, DK, EW, E, FIN, F, GR, HR, H, IRL, I, LT, L, LR, M, NL, PL, P, R, S, SLO, SK ausgeliefert werden.